6月13日,華盛頓大學醫學院的科學家們在《Nature Genetics》雜志上提出了一種新的計算工具——HotSpot3D,可通過蛋白質3D結構來識別突變-突變(mutation–mutation)和突變-藥物(mutation–drug)的聚類關系,并找出這些聚類與功能突變、結構域以及蛋白之間的對應關系。研究人員通過檢測癌癥基因圖譜中19種癌癥的4000個腫瘤組織,確定了6000多種聚類的相互作用,而大多數的相互作用是無法通過常規方法檢測到的。此外,研究人員通過藥物與變異之間的多維相互關系確定了800多個具有前景的可藥化的突變點,對未來癌癥療法有很大意義。
論文的資深作者、醫學副教授和腫瘤科計算生物學主任丁莉(Li Ding)博士說:“直到最近,針對蛋白質在癌癥中所起作用的研究都是將焦點放在這些蛋白的未折疊或線性序列上。然而在體內,蛋白質天然以一種特異的3D結構存在。我們開發出了一種計算方法,使得我們能夠在尋找驅動癌癥的突變時將這些3D結構考慮在內。”
在該研究中,研究人員確定了TP53、PTEN、VHL、EGFR以及FBXW7基因中的369個罕見突變,還確定了RUNX1、MTOR、CA3、PI3和PTPN11基因的99個中位復發突變,所有聚類都具有潛在的功能影響。
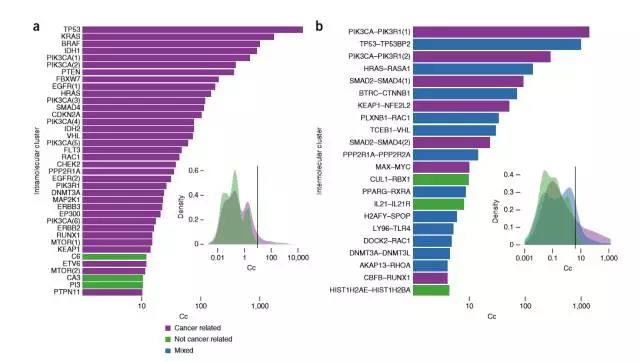
圖片來源:Nature Genetics
如圖a所示,與癌癥相關性最高的五大蛋白為TP53、KRAS、BRAF和PIK3CA、IDH1,這與預期的結論相同,編碼這些蛋白的基因在癌癥中的突變率最高。圖b所示,蛋白之間集群,與癌癥相關程度越大的蛋白之間的親密性越高。
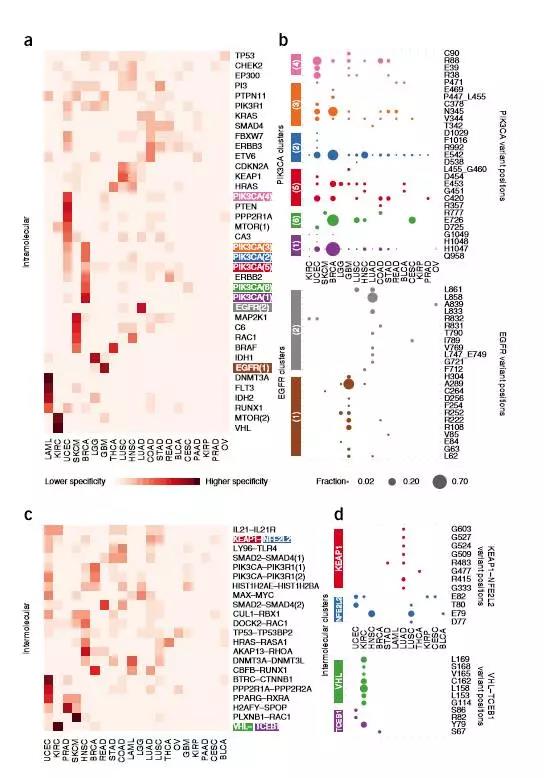
圖片來源:Nature Genetics
研究人員發現48個蛋白激酶與21種藥物相互作用
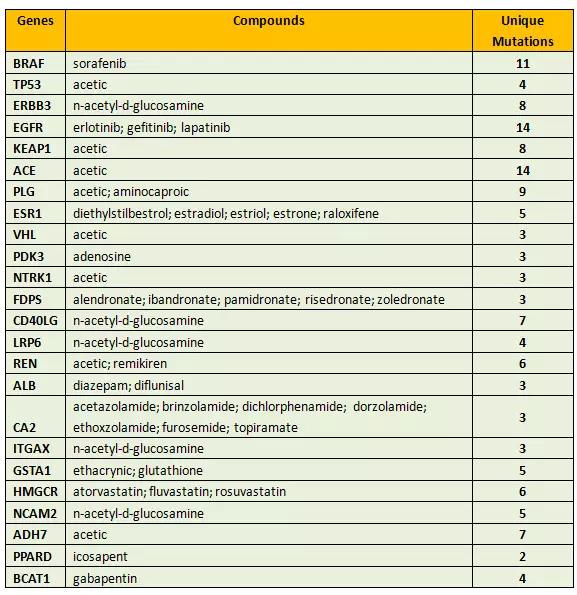
研究人員確定了394種突變-藥物(mutation–drug)集群,包含了153種藥物和359種基因之間的關系,確定了844種突變在候選藥物靶點上具有很大前景。下圖為與癌癥相關性較高的具有前景的候選藥物靶點(突變點)。
作者簡介:
牛北方:
論文第一作者,現任中科院計算機網絡信息中心研究員、高性能計算部副主任、中科華申牛北方聯合實驗室主任、中科院百人計劃【曾任圣路易斯華盛頓大學醫學院McDonnell基因組研究所研究員(Staff Scientist)】。
丁莉:
早年畢業于復旦大學,博士畢業于美國猶他大學,曾在斯坦福大學生物化學系從事博士后研究。曾成功領導了肺腺癌的基因組學研究,并鑒定出導致肺癌的關鍵基因和通路。她還與其他同事一起分析了一位白血病患者的腫瘤和皮膚基因組,這也是第一個完全測序并分析的癌癥基因組。丁莉博士2014年入選湯森路透評選的全世界17位最具影響力的科學家之一。
參考文獻:Protein-structure-guided discovery of functional mutations across 19 cancer types. Niu B, et al. Nat Genet. 2016 Jun 13.